Die Forschungsgruppe beschäftigt sich mit der Entwicklung einer sicheren und effektiven Kryokonservierung sowie neuen Einfrier- und Auftaumethoden für die Langzeitlagerung und dem Biobanking von Zellen sowie nativem und künstlichem Gewebe (Tissue-Engineering Konstrukte). Unser Ziel ist, die Verfügbarkeit (ready-to-use) von klinisch-relevanten Zellen und Geweben für die Forschung (Medikamentenentwicklung und Testung) und klinische Anwendungen (Gewebe- und Organregeneration) zu gewährleisten. Unsere Forschungs-aktivitäten werden im Rahmen nationaler und internationaler Projekte durchgeführt.
Die Forschungsschwerpunkte der Gruppe sind nachfolgend zusammen gefasst:
Untersuchung optimaler Einfrier- und Auftauparameter sowie neuer xenofreier, nicht-toxischer Einfrierbedingungen mit dem Ziel, eine hohe Zellvitalität und Funktionalität kryokonservierter Materialien (klinisch relevante Zellen, Gewebe und Tissue Engineering Konstrukte) nach dem Auftauen zu gewährleisten. Die Kryokonservierung erfolgt u.a. in Multiwell-Platten und Kryobeuteln (cryobags).

Entwicklung von Methoden zur induzierten (aktiv gesteuerten) Eisnukleation bei optimalen Temperaturen mittels Elektrofreezing. Die Durchführung der Eiskristallbildung bei optimalen Temperaturen während des Einfrierens soll die Zellvitalität und Funktionalität erhöhen. Um die Verwendung toxischer Gefrierschutzmittel, wie z.B. Dimethylsulfoxid zu vermeiden, werden eigentlich nicht membrangängige Gefrierschutzmitteln wie Zucker mittels Elektroporation in die Zellen eingebracht (in Kooperation mit Prof. Dr. Miklavčič, Universität Ljubljana, Slowenien).
Entwicklung von Methoden zur Visualisierung und Analyse der Eiskristallbildung, des Eiswachstums und der Eisrekristallisation während des Einfrierens und Auftauens, um die Vorgänge während der Kryokon-servierung zu untersuchen und neue Gefrierschutzmittel für ein effizientes Biobanking zu entwickeln.

Mikroskopie-basierte Bildgebung und Analyse während der Kryokonservierung, Gefriertrocknung und dem Auftauen von Zellen und Geweben sowie Bildverarbeitung und Bildsegmentierung (inkl. Deep Neuronal Networks). In Kooperation mit der Abteilung Biomedizintechnik der Kharkiv National University for Radioelectronics (Prof. Oleh Avrunin) entwickeln wir Software-basierte Methoden für die Bildanalyse.
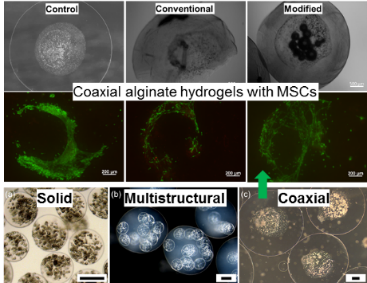
Zellschutz durch Alginat-Verkapselung. Alginat-Hydrogele (Solide und multistrukturelle Beads, koaxiale Core-Shell Alginat-Kapseln) werden mittels Elektrospraying- und Airflow-Verfahren hergestellt. Die Alginat-Membran schützt die eingekapselten Zellen vor externen Scherkräften. Durch ihre Semipermeabilität können die Alginat-Kapseln Gefrierschutzmittel aufnehmen und so schädliche Vorgänge während der Eiskristallbildung und -wachstum reduzieren. Alginat-Hydrogele werden u.a. für die Medikamentenentwicklung und -Testung verwendet werden.
Rheologische Analyse von Gefrierschutzlösungen und Untersuchung ihres Einflusses auf die Zellen während der Vorbehandlung, des Einfrierens, der Lagerung und des Auftauens.
Analyse von biochemischen Veränderungen, Zell-Zell- und Zell-Gerüst-Interaktionen während des Einfrierens, Auftauens und der Gefriertrocknung; Untersuchung der Diffusion von Gefrierschutzmittel in Zellen und Geweben bei dynamischen Bedingungen in Diffusionskammern.
Analyse von genetischen und epigenetischen Veränderungen in kryokonservierten Zellen und Geweben. Ziel ist die Minimierung dieser Effekte, um die Sicherheit der entwickelten Kryo¬kon¬ser-ierungsprotokolle für die Langzeitlagerung von klinisch relevanten Stammzellen und Geweben zu gewährleisten.
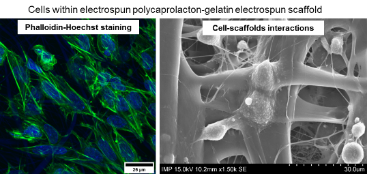
Untersuchung der hypothermen Lagerung von zellbesiedelten elektrogesponnen Konstrukten mit dem Ziel, eine hohe Zellvitalität und Funktionalität der konservierten Tissue-Engineering Konstrukte unter hypothermen Bedingungen zu ermöglichen. Vergleichend erfolgt für diese Konstrukte parallel die Konservierung unter kryogenen Bedingungen.
Die Forschungsgruppe ist interessiert an Auftragsforschung für die Industrie, internen und externen Partnern in Bezug auf die Nutzung der Geräte, Austausch von Know-How und die Entwicklung neuer Methoden in der Kryotechnik. Die folgenden Geräte und Methoden können nach Anfrage genutzt werden:
Methoden für die Bildgebung und Analyse von Zellen und Gewebe





Publikationen (ausgewählt, 2016-2021)
6. M. Tymkovych, O. Gryshkov, O. Avrunin, K. Selivanova, Y. Nosova, V. Mutsenko, N. Shushliapina, B. Glasmacher. Application of SOFA Framework for Physics-Based Simulation of Deformable Human Anatomy of Nasal Cavity. In: Jarm T., Cvetkoska A., Mahnič-Kalamiza S., Miklavcic D. (eds) 8th European Medical and Biological Engineering Conference. EMBEC 2020. IFMBE Proceedings, vol 80. Springer, Cham. https://doi.org/10.1007/978-3-030-64610-3_14.
7. V. Mutsenko, M. Chasnitsky, V. Sirotinskaya, M. Müller, B. Glasmacher, I. Braslavsky, O. Gryshkov. Directional Freezing of Cell-Seeded Electrospun Fiber Mats for Tissue Engineering Applications. In: Jarm T., Cvetkoska A., Mahnič-Kalamiza S., Miklavcic D. (eds) 8th European Medical and Biological Engineering Conference. EMBEC 2020. IFMBE Proceedings, vol 80. Springer, Cham. https://doi.org/10.1007/978-3-030-64610-3_45.
8. O. Gryshkov, V. Mutsenko, J. Dermol-Černe, D. Miklavčič, B. Glasmacher. Electroporation of Cell-seeded Electrospun Fiber Mats for Cryopreservation. In: Jarm T., Cvetkoska A., Mahnič-Kalamiza S., Miklavcic D. (eds) 8th European Medical and Biological Engineering Conference. EMBEC 2020. IFMBE Proceedings, vol 80. Springer, Cham. https://doi.org/10.1007/978-3-030-64610-3_55.
9. S. Leal-Marin, T. Kern, N. Hofmann, O. Pogozhykh, C. Framme, M. Börgel, C. Figueiredo, B. Glasmacher, O. Gryshkov. Human Amniotic Membrane: A review on tissue engineering, application, and storage. J. Biomed. Mater. Res. B 2020, 1-18, https://doi.org/10.1002/jbm.b.34782.
10. D. Pogozhykh, D. Eicke, O. Gryshkov, W.F. Wolkers, K. Schulze, C.A. Guyman, R. Blasczyk, C. Figueiredo. Towards Reduction or Substitution of Cytotoxic DMSO in Biobanking of Functional Bioengineered Megakaryocytes. Int. J. Mol. Sci. 2020, 21(20), 7654, doi.org/10.3390/ijms21207654.
11. O. Pogozhykh, N. Hofmann, O. Gryshkov, C. von Kaisenberg, M. Mueller, B. Glasmacher, D. Pogozhykh, M. Börgel, R. Blasczyk, C. Figueiredo. Repeated freezing procedures preserve structural and functional properties of amniotic membrane for application in ophthalmology. Int J Mol Sci.2020;21(11): 4029, doi: 10.3390/ijms21114029.
12. V. Mutsenko, S. Knaack, L. Lauterboeck, D. Tarusin, B. Sydykov, R. Cabiscol, D. Ivnev, J. Belikan, A. Beck, D. Dipresa, A. Lode, T.El. Khassawna, M. Kampschulte, R. Scharf, A.Yu Petrenko, S. Korossis, W.F. Wolkers, M. Gelinsky, B. Glasmacher, O. Gryshkov. Effect of 'in air' freezing on post-thaw recovery of Callithrix jacchus mesenchymal stromal cells and properties of 3D collagen-hydroxyapatite scaffolds. Cryobiology 2020;92: 215-230, doi: 10.1016/j.cryobiol.2020.01.015.
13. F. Bajerski, A. Bürger, B. Glasmacher, E.R.J. Keller, K. Müller, K. Mühldorfer, M. Nagel, H. Rüdel, T. Müller, J. Schenkel, J. Overmann. Factors determining microbial colonization of liquid nitrogen storage tanks used for archiving biological samples. Appl Microbiol Biotechnol. 2020;104(1): 131-144.
14. V. Mutsenko, A. Barlič, T. Pezić, J. Dermol-Černe, B. Sydykov, W.F. Wolkers, I. Katkov, D. Miklavčič, B. Glasmacher, O. Gryshkov. Me2SO- and serum-free cryopreservation of mesenchymal stromal cells using electroporation of sugars. Cryobiology 2019;91: 104-114.
15. O. Gryshkov, M. Müller, S. Leal-Marin, V. Mutsenko, S. Suresh, V.M. Kapralova, B. Glasmacher. Advances in the application of electrohydrodynamic fabrication for tissue engineering. J. Phys. Conf. Ser. 2019;1236 012024, doi 10.1088/1742-6596/1236/1/012024.
16. V. Mutsenko, O. Gryshkov, O. Rogulska, A. Lode, A.Yu. Petrenko, M. Gelinsky, B. Glasmacher, H. Ehrlich. Chitinous Scaffolds from Marine Sponges for Tissue Engineering. In: A.H. Choi, B. Ben-Nissan (eds.) (2018). Marine-Derived Biomaterials for Tissue Engineering Applications, Springer Series in Biomaterials Science and Engineering (SSBSE) 2019: 285-307, doi 10.1007/978-981-13-8855-2_13.
17. Patent DE 10 2018 100 844 (2019, pending), Process for freezing of biological cells and/or tissue in a fluid.
18. M.V. Prykhodko, M.Y. Tymkovych, O.G. Avrunin, V.V. Mutsenko, O. Gryshkov, B. Glasmacher. Image processing for automated microscopic analysis of ice recrystallization process during isothermal annealing. Int J Bioelectromagnetism 2018;20(1): 72-75.
19. M.Yu. Tymkovych, O.G. Avrunin, V.G. Paliy, M. Filzow, O. Gryshkov, B. Glasmacher et al. Automated method for structural segmentation of nasal airways based on cone beam assisted computed tomography. Proceedings of SPIE, Chapter: 10445, Editors: Romaniuk Ryszard S., Linczuk Maciej, pp.104453F, doi: 10.1117/12.2280922.
20. V.M. Mutsenko. Cryopreservation of mesenchymal stromal cells within tissue engineering approaches (2019). PhD thesis, Hannover Medical School, Hannover.
21. V.V. Mutsenko, V.V. Bazhenov, O. Rogulska, D.N. Tarusin, K. Schütz, S. Brüggemeier et al. 3D chitinous scaffolds derived from cultivated marine demosponge Aplysina aerophoba for tissue engineering approaches based on human mesenchymal stromal cells. Int J Biol Macromol. 2017;104(B): 1966-1974.
22. V.V. Mutsenko, O. Gryshkov, L. Lauterboeck, O. Rogulska, D.N. Tarusin, V.V. Bazhenov et al. Novel chitin scaffolds derived from marine sponge Ianthella basta for tissue engineering approaches based on human mesenchymal stromal cells: Biocompatibility and cryopreservation. Int J Biol Macromol. 2017;104(B): 1955-1965.
23. A. Chatterjee, D. Saha, H. Niemann, O. Gryshkov, B. Glasmacher, N. Hofmann. Effects of cryopreservation on the epigenetic profile of cells. Cryobiology 2017;74: 1-7.
24. L. Lauterboeck, W.F. Wolkers, B. Glasmacher. Cryobiological parameters of multipotent stromal cells obtained from different sources. Cryobiology 2017;74: 93-102.
25. D. Pogozhykh, Y. Pakhomova, O. Pervushina, N. Hofmann, B. Glasmacher, G. Zhegunov. Exploring the Possibility of Cryopreservation of Feline and Canine Erythrocytes by Rapid Freezing with Penetrating and Non Penetrating Cryoprotectants. PLoS ONE 2017;12(1): e0169689, DOI: 10.1371/journal.pone.0169689.
26. L. Lauterboeck, D. Saha, A. Chatterjee, N. Hofmann, B. Glasmacher. Xeno-free cryopreservation of bone marrow derived multipotent stromal cells from Callithrix jacchus. Biopreserv Biobank. 2016;4(6): 530-538.
27. A. Chatterjee, D. Saha, B. Glasmacher, N. Hofmann. Chilling without regrets: Deciphering the effects of cryopreservation on the epigenetic properties of frozen cells will benefit the applications of cryotechnology. EMBO Reports 2016;17: 292-295.
28. A. Chatterjee. Effects of cryopreservation on histone posttranslational modifications of stem cells (2016). PhD Thesis, Hannover Medical School, Hannover.
29. D. Saha. Effect of cryopreservation procedures on the viability, genetic and epigenetic stability of multipotent stromal cells (2016). PhD thesis, Hannover Medical School, Hannover.
30. L. Lauterböck. Cryopreservation of stem cells using induced nucleation (2016). PhD thesis Hannover Medical School, Hannover.
31. A. Repanas, L. Lauterboeck, D. Marvilas, B. Glasmacher. Polycaprolactone and polycaprolactone/ chitosan electrospun scaffolds for tissue engineering applications. Sch J App Med Sci. 2016:4(1C): 228-232.
32. O. Gryshkov. High voltage encapsulation of multipotent stromal cells in alginate (2015). PhD thesis, Hannover Medical School, Hannover.
33. O. Gryshkov, N. Hofmann, L. Lauterboeck, D. Pogozhykh, T. Mueller, B. Glasmacher. Multipotent Stromal Cells Derived from Common Marmoset Callithrix Jacchus within Alginate 3D Environment: Effect of Cryopreservation Procedures. Cryobiology 2015:71(1): 103-111.
34. L. Lauterboeck, N. Hofmann, T. Mueller, B. Glasmacher. Active control of the nucleation temperature enhances freezing survival of multipotent mesenchymal stromal cells. Cryobiology 2015;17(3): 384-390.
35. N. Hofmann, H. Sun, A. Chatterjee, D. Saha, B. Glasmacher. Thermal Pretreatment Improves Viability of Cryopreserved Human Endothelial Cells. Biopreserv Biobank. 2015;13: 348-355

Janina Hagedorn
+49 511 762 3822
hagedorn(at)imp.uni-hannover.de
NIFE
Stadtfelddamm 34
30625 Hannover
LUH
Institut für Mehrphasenprozesse
An der Universität 1
Gebäude 8143, 2.OG, Büro 211, 30823 Garbsen
Auszeichnungen
Vorträge
Weitere Forschungsthemen und Innovationen der Forschungsgruppe “Kryotechnik” des Instituts für Mehrphasenprozesse sind hier aufgeführt: imp.uni-hannover